🔦 【Angew.Chem.】突破极限:癌细胞的“隐形杀手”!2.7 eV宽带隙纳米粒子,氢气产率高出百倍,如何实现免疫激活/铁死亡双重抗癌?
✨文章标题:NIR-II-Photopyroelectric Catalysis for Immunoactivation/Ferroptosis Combined Therapy of Tumor ✉️作者:Prof. Qianjun He等 🔗链接:https://doi.org/10.1002/anie.202518305
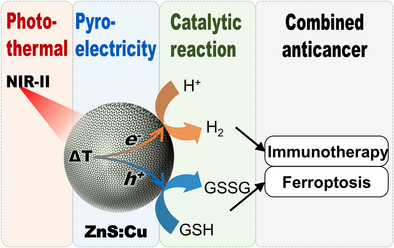
🚀 从“痛点”到“突破”:光催化抗癌的终极难题
想象一下,想要用“光”来治疗肿瘤,光线必须能穿透人体组织,直达癌细胞的深处。在医学和光电催化领域,我们都渴望使用近红外二区(NIR-II,1000-1700 nm),它就像一束“隐形”的、具有极高穿透力的光束,比常规光线能钻得更深,因此是驱动体内光催化治疗的理想选择。
然而,在这个领域存在一个令人头疼的 “鱼和熊掌不可兼得”的悖论:想要吸收NIR-II光线来启动光催化反应,催化剂的能带间隙(Bandgap)就必须设计得非常窄(例如,对于1060 nm光线,能带间隙要小于1.17 eV)。
但问题是,能带间隙越窄,催化剂的氧化还原电位就越低,就像一个电位很弱的电池,导致它产生氢气的能力(催化效率)变得非常差,几乎可以忽略不计。这是一个涉及半导体物理的根本性瓶颈。传统的直接NIR-II光催化因此陷入了效率低下的泥潭。科学家们亟需一种全新的、间接的催化策略来彻底绕开这一物理限制。这项研究正是为此而来,它提出了一种光热-热释电串联催化(Photopyroelectric Catalysis) 的新概念,旨在用一条“曲线救国”的道路,实现高效的NIR-II光驱动催化,并将其应用于一场前所未有的肿瘤联合疗法。
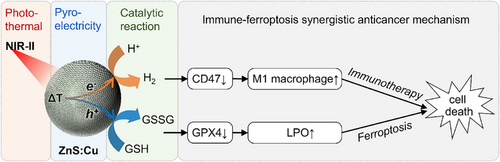
🔬 核心方法与技术细节:打造癌细胞的“热震荡电池”
这项研究的核心,是设计并合成了新型的ZnS:Cu纳米催化剂。这个纳米粒子可不是普通的材料,它被赋予了两种至关重要的“超能力”,成功绕开了上述的能带间隙限制:
🌟 创新机制一:光热-热释电串联催化(Photopyroelectric Catalysis)
传统的困境在于必须让光直接驱动催化反应。而这项研究的巧妙之处在于,它将整个过程拆解成了一个高效的级联反应:
吸收光线,转化为热能(光热效应): ZnS:Cu纳米粒子在掺杂铜离子后,获得了在NIR-II波段的显著吸收能力。当1060 nm的NIR-II激光照射到肿瘤内的ZnS:Cu上时,它首先高效地将光能转化为热能,光热转化效率高达52.4%。
热能驱动发电(热释电效应): 关键的突破点在于,ZnS:Cu本身是一种具有热释电(Pyroelectric)特性的材料。热释电效应可以通俗地理解为一种“热震荡电池”:当材料受到温度变化(加热或冷却) 时,其晶体内部的极化状态会发生改变,从而在表面产生瞬间的正电荷(空穴,) 和负电荷(电子,)。
电荷分离,启动催化(催化反应): 这种由温度变化驱动的电荷分离(热释电效应),成功地替代了传统光催化中由光子直接激发的电荷分离。这意味着:催化剂的催化电位不再与光的波长直接挂钩! 只需要光线能高效转化为热能即可。
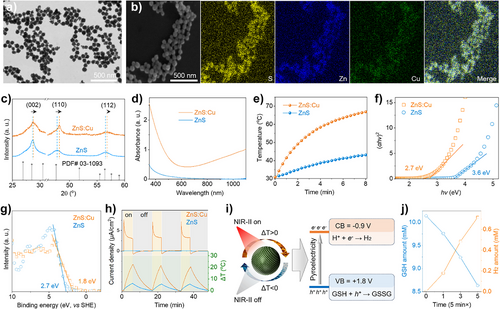
这个 “光-热-电-催化” 的串联机制,彻底规避了“窄带隙”的限制。ZnS:Cu的能带间隙为2.7 eV,远远高于NIR-II光线所需的1.17 eV。宽能带间隙带来了巨大的优势:更高的氧化还原电位,即更强的催化活性。它的导带最小值(CBM)为,价带最大值(VBM)为(相对于SHE),这个强大的电位足以高效地完成两个核心的催化任务。
🛡️ 创新机制二:双重抗癌物质的生成与消耗
在NIR-II激光照射下,肿瘤内的ZnS:Cu就像一个微型工厂,同时进行两项关键的催化反应,分别由它产生的电子和空穴驱动:
电子通道():氢气()的生成。
- 在导带(CB,)上的高能电子,能够高效地还原肿瘤内的氢离子(),生成具有抗癌作用的氢气()。这个反应可以表示为:。
空穴通道():谷胱甘肽(GSH)的氧化消耗。
- 在价带(VB,)上的高能空穴,则被用于氧化消耗肿瘤细胞内过量表达的谷胱甘肽(GSH)。GSH是肿瘤细胞抵抗氧化应激、保持“安稳生活”的关键物质。这个反应可以表示为:。
总之,ZnS:Cu利用了NIR-II光诱导的温度波动,通过热释电效应将热能转化为化学能,实现了高效率的氢气生成(用于免疫激活)和GSH消耗(用于诱导铁死亡)这一免疫激活/铁死亡协同治疗的全新策略。
📊 数据背后的创新与颠覆性:一个了不起的成就
这项研究的价值,需要通过一系列硬核数据的对比才能充分体现。ZnS:Cu纳米催化剂的表现,堪称是颠覆性的。
🥇 性能指标:催化效率的惊人飞跃
首先看最核心的催化效率:
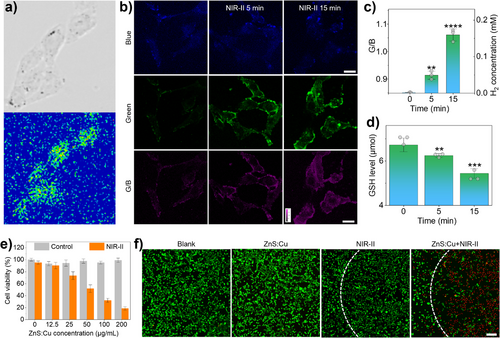
氢气生成效率: ZnS:Cu在NIR-II光驱动下的氢气生成效率高达 。
效率对比: 这一数值,比先前报道的直接NIR-II光催化体系的效率(例如)高出了两个数量级,即提升了百倍以上!
这个惊人的效率提升,正是光热电串联催化策略绕开物理瓶颈、利用宽带隙带来的高氧化还原电位的直接证明。在体外实验中,ZnS:Cu在NIR-II光照射下,能有效地生成氢气,并消耗谷胱甘肽,并且生成的氢气和消耗的GSH的摩尔比始终保持在1:2左右,完美印证了电子和空穴分别驱动这两个反应的机制。
🦠 协同效应:实现1+1 > 2 的抗癌效果
单一的ZnS:Cu注射或单独的NIR-II照射,对癌细胞几乎没有明显的杀伤作用。但当两者联合,即开启NIR-II光热电催化时,抗癌效果显著提升:
体外细胞杀伤: 在的浓度下,ZnS:Cu + NIR-II联合治疗,使得4T1癌细胞的存活率降低到了约18.7%,展示出卓越的体外抗肿瘤性能。
协同机制验证: 研究通过引入电子和空穴的牺牲剂,验证了这两种产物对最终疗效的贡献。单独的“氢气疗法”(电子产物)和单独的“空穴疗法”(GSH消耗)均能造成约35%的肿瘤细胞杀伤,而两者联合则达到了79.6%的高效抗肿瘤效果。
⚔️ 免疫激活与铁死亡的双重奏
这项工作的颠覆性不仅在于高效率,更在于其双通路协同治疗:
免疫激活(氢气通道):
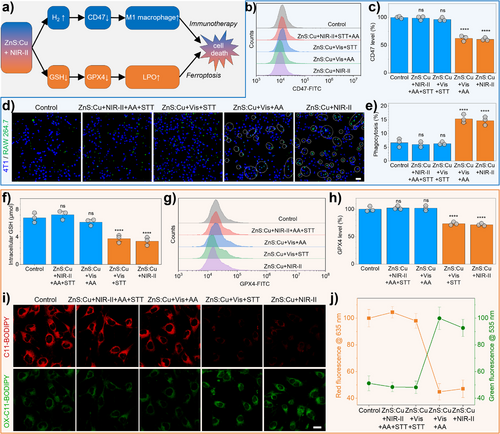
CD47下调: 催化产生的氢气,能够显著下调肿瘤细胞表面CD47的表达水平(CD47是一种被称为“别吃我”的信号)。实验数据显示,氢气疗法(或ZnS:Cu + NIR-II组)能导致CD47表达水平下降约40%。
巨噬细胞极化: CD47的下调,成功激活了肿瘤免疫。在体内实验中,ZnS:Cu + NIR-II治疗显著提高了巨噬细胞在肿瘤内的浸润,并促使它们极化为M1型巨噬细胞(M1型是具有杀伤肿瘤能力的“战士”)。表现为M2型巨噬细胞的标志物IL-10水平显著下降,而M1型巨噬细胞的标志物IL-12P40水平明显上调。
铁死亡诱导(GSH消耗通道):
GSH水平骤降: 空穴消耗肿瘤细胞内的谷胱甘肽(GSH),导致细胞抗氧化系统崩溃。在体外和体内实验中,ZnS:Cu + NIR-II组的GSH水平均有显著下降,在体外下降了约44.6%。
GPX4失活与LPO积累: GSH的消耗进一步导致细胞内防御性谷胱甘肽过氧化物酶4(GPX4)失活,最终引发脂质过氧化物(LPO)大量积累。这种积累正是细胞凋亡的铁死亡(Ferroptosis) 途径。
💯 终极证明:完全清除与零复发转移
最终,在活体小鼠(乳腺癌自发转移模型)上的治疗效果是这项研究最强有力的证据:
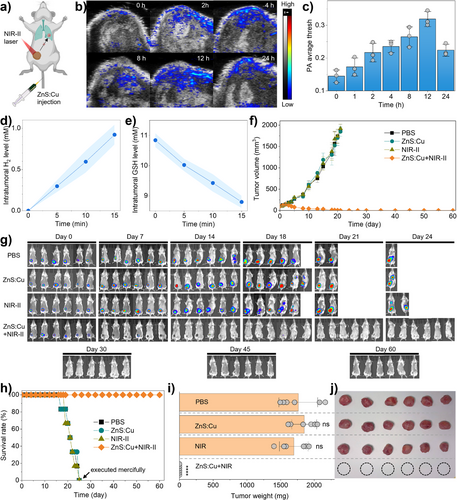
肿瘤完全清除: 经过14天的ZnS:Cu + NIR-II治疗后,小鼠的原发性肿瘤被完全清除。
零复发/零转移: 在长达60天的观察期内,ZnS:Cu + NIR-II组的小鼠没有观察到任何复发或转移,而PBS、ZnS:Cu、NIR-II单独治疗组在第14天就开始出现肺部转移,并在第24天存活率接近0%。
100%存活率: ZnS:Cu + NIR-II治疗组的小鼠在60天内保持100%的存活率。
这一系列的数据清晰地证明,通过“光热电串联催化”实现的高效氢气生成和GSH消耗,成功激活了氢气-CD47-M1免疫通路和GSH-GPX4-LPO铁死亡通路,实现了对肿瘤原发灶的有效抑制和对转移灶的显著抑制,展示出巨大的临床转化潜力。
🔮 应用展望、局限性与未来路线图:从实验室到临床
🌍 广阔的应用展望
这项工作为高效利用NIR-II光驱动催化反应开辟了一条全新的道路,其意义远不止于肿瘤治疗。
催化医学: 除了肿瘤免疫/铁死亡协同治疗,这种高效的NIR-II催化平台未来可以应用于其他需要局部、精确、深层催化干预的疾病,例如组织工程和抗炎治疗(氢气本身具有抗炎作用)。
太阳能和清洁能源: 这种光热电催化机制,在太阳能到化学能的转化领域具有巨大的潜力,特别是高效驱动水分解制氢(氢能)等,能够克服传统光催化对太阳光中紫外/可见光区域的依赖,更高效地利用整个太阳光谱,尤其是低能光子。
🛑 客观局限性与挑战
虽然结果令人振奋,但任何前沿研究都有其局限性,并需要在临床转化前解决:
热释电效率依赖温度波动: 热释电效应的效率依赖于温度的波动(),即激光的开启和关闭过程。虽然在肿瘤内实现了热能的局部利用,但在大体积或深层肿瘤中,如何确保均匀且高效的温度波动,仍是需要深入研究的工程问题。
纳米粒子的大规模制备: 从实验室到临床,需要确保ZnS:Cu纳米粒子的大规模、高重复性、高纯度制备,同时进一步优化其在体内的长期生物安全性和代谢清除路径,尽管目前的数据显示出良好的短期生物相容性。
临床转化所需的系统集成: 将NIR-II激光系统、纳米催化剂的给药和精确的温度/催化产物监测整合到一个可操作的临床方案中,还需要大量的系统工程和规范化工作。
🗺️ 未来路线图
未来研究将着重于:
催化剂优化: 探索其他具有高光热效率和高热释电系数的单相多功能材料,以进一步提升催化效率和体系的稳定性。
智能化调控: 开发能够响应体内微环境(如pH值、特定酶)的智能纳米系统,实现按需释放氢气和GSH消耗,进一步提高治疗的特异性和安全性。
多模态成像集成: 将光声(PA)成像等技术与催化治疗深度融合,实现对纳米粒子在肿瘤内分布的实时监测,以及对治疗效果(例如温度变化、氢气产率)的在线评估,确保治疗的精准性。
总之,这项研究为我们展示了如何通过巧妙地设计间接催化机制,突破光电催化领域中的核心物理限制,以极高的效率,同时激活肿瘤的免疫系统并诱导细胞死亡。从百倍效率的提升到对转移肿瘤的彻底清除,这无疑是癌症治疗领域令人激动的一步,预示着一个由 “隐形光束”驱动的精准催化治疗时代即将到来。
【彩蛋】
为什么说热释电催化是“曲线救国”?传统光催化是直接用光子(能量包)把电子“踢”出去,要求光子的能量必须等于或大于能带间隙。而“光热电”策略是:用光子把材料“加热”(光热),用加热产生的温度波动去“摇晃”材料内部的晶体结构(热释电),结构一摇晃,电子和空穴就分开了,然后去干活。光只是一个能量的 “搬运工”,把能量从NIR-II光转移到了催化剂的 “晶体振动能” 上,绕过了对光子能量的苛刻要求!这种能量的巧妙转换和利用,正是科学家们对自然规律的精妙驾驭。